
Американские врачи 16 марта начнут клинические испытания вакцины от коронавируса . Ее введут 45 молодым здоровым добровольцам. Однако даже в случае успеха широкое использование лекарства начнут не раньше чем через год. Где еще разрабатывают вакцину и почему так долго?
Лекарство на подходе?
«Образцы не содержат вирус, поэтому вероятность заражения участников эксперимента исключена», — пишут в.
По информации издания, испытания проведут специалисты национальных институтов здоровья и фармацевтической компании Moderna в одном из исследовательских центров города Сиэтла (штат Вашингтон). Там зарегистрировали самое большое количество случаев заражения коронавирусом в США.
При этом, даже если испытания пройдут успешно, для начала широкого использования любой потенциальной вакцины требуется от года до 18 месяцев. Об этом заявил директор Национального института изучения аллергических и инфекционных заболеваний. Придется исследовать еще тысячи людей, чтобы убедиться, действительно ли вакцина работает и не причиняет ли вреда. И это все еще будут рекордные сроки изготовления препарата.
Производители знают, что ожидание мучительно для напуганных вирусом людей. На ускоренном создании лекарства настаивал и. Он же сообщил, что работа «продвигается очень быстро» и что он надеется увидеть спасительную вакцину «относительно скоро».
Исследования сегодня
На сегодня нет проверенных способов лечения коронавируса. Однако десятки исследовательских групп по всему миру пытаются найти лекарство, так как количество случаев заражения COVID-19 продолжает расти.
Ученые из Гонконга, США, Германии, Франции, Австралии, Канады и Израиля активно разрабатывают вакцину против коронавируса. Многие проекты поддерживает CEPI — международное объединение по борьбе с эпидемиями, которое финансируется за счет государственных средств и частных пожертвований.
Различные ученые используют разные типы вакцин, например, прививки, созданные с использованием новых технологий, которые не только производятся быстрее привычных, но и могут оказаться более эффективными. Некоторые исследователи работают над так называемыми временными вакцинами. Они должны сберечь здоровье человека на один-два месяца, пока более долгосрочный вариант находится в разработке.
Связанные вопросы и ответы:
1. Какие компании участвуют в разработке вакцины от коронавируса в США
Ответ: В разработке вакцины от коронавируса в США участвуют компании Moderna, Pfizer, Johnson & Johnson, AstraZeneca и другие.
2. Какие организации проводят клинические испытания вакцины от коронавируса в США
Ответ: В США клинические испытания вакцины от коронавируса проводятся организациями, такими как Национальный институт аллергии и инфекционных заболеваний (NIAID), Центры по контролю и профилактике заболеваний (CDC) и другие.
3. Сколько участников участвует в клинических испытаниях вакцины от коронавируса в США
Ответ: В клинических испытаниях вакцины от коронавируса в США участвует большое количество людей, количество которых зависит от конкретной вакцины и фазы испытаний.
4. Какие фазы клинических испытаний вакцины от коронавируса проходят в США
Ответ: В США клинические испытания вакцины от коронавируса проходят в нескольких фазах. Первая фаза включает испытание на безопасность и дозу на маленькой группе людей. Вторая фаза включает испытание на эффективность и безопасность на большей группе людей. Третья фаза включает испытание на эффективность и безопасность на большой группе людей.
5. Как быстро может быть разработана вакцина от коронавируса в США
Ответ: Время разработки вакцины от коронавируса в США зависит от многих факторов, таких как эффективность вакцины, безопасность и количество людей, участвующих в клинических испытаниях. Однако, благодаря усилиям многих организаций и компаний, разработку вакцины от коронавируса в США можно быстро продвинуть.
6. Как будет распространяться вакцина от коронавируса в США
Ответ: Вакцина от коронавируса в США будет распространяться через систему здравоохранения страны, включая государственные и частные медицинские учреждения.
7. Как будет оцениваться эффективность вакцины от коронавируса в США
Ответ: Эффективность вакцины от коронавируса в США будет оцениваться на основе результатов клинических испытаний, которые будут проводиться на большой группе людей.
8. Какие последствия могут иметь клинические испытания вакцины от коронавируса в США
Ответ: Клинические испытания вакцины от коронавируса в США могут иметь важные последствия для борьбы с эпидемией коронавируса. Вакцина может помочь предотвратить распространение вируса и снизить количество случаев заболевания и смертей. Однако, важно продолжать соблюдать меры предосторожности, такие как ношение масок, социальное дистанцирование и соблюдение гигиены рук, чтобы помочь предотвратить распространение вируса.
Какие компании или организации проводят клинические испытания вакцины от коронавируса в США
Американский производитель лекарств Pfizer объявил в понедельник, 9 ноября о завершении первых испытаний своей вакцины от коронавируса на людях. Новая вакцина оказалась достаточно эффективной в борьбе с COVID-19, что является многообещающим достижением, поскольку мир с нетерпением ждал каких-либо положительных новостей во время пандемии, в результате которой уже погибли более 1,2 миллиона человек . Компания заявила, что вакцина оказалась более чем на 90% эффективна в предотвращении заболевания среди добровольцев, у которых до этого не было коронавирусной инфекции. Если результаты подтвердятся, такой уровень защиты поставит новую вакцину от коронавируса в один ряд с высокоэффективными вакцинами от таких болезней, как корь.
Как и российская вакцина, американская будет вводиться двумя дозами
Американская вакцина от коронавируса
Pfizer разработала вакцину совместно с немецким производителем лекарств BioNTech инекоторые подробности клинических испытаний, основанные на первом обзоре данных внешней группой экспертов. Компания планирует обратиться в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США с просьбой об экстренном разрешении на введение двухдозовой вакцины после того, как соберет данные о том, что вакцина безопасна.
По словам руководителей компании, к концу года будет произведено достаточно доз, чтобы вакцинировать от 15 до 20 миллионов человек .
Это исторический момент, — говорит Катрин Янсен, старший вице-президент и руководитель отдела исследований и разработок вакцин компании Pfizer. — Во время пандемии мы поставили себе цель, которую никто пока не достиг — разработать вакцину в течение года.
В то же время не совсем корректно утверждать, что в мире пока нет вакцин от коронавируса. Так, еще в августе Россия заявила, и сейчас активно разрабатывает еще одну вакцину.

Штаб-квартира компании BioNTech в Германии
Поможет ли вакцина от коронавируса?
Ученые призывают не сильно надеяться на эти результаты и не преувеличивать их до тех пор, пока не будут собраны более подробные данные о безопасности и эффективности вакцины. И никто пока не знает,от коронавируса.
Тем не менее, такое развитие событий делает Pfizer первой коммерческой компанией, объявившей о положительных результатах испытаний вакцины против коронавируса. Этой новости оказалось достаточно, чтобы дать людям надежду на возвращение в привычное русло — в частности, резко выросли акции компаний, которые занимались авиаперевозками и другим бизнесом, который больше всего пострадал в пандемию.
Акции компании EasyJet выросли на 30%
Кто разрабатывает вакцины от коронавируса?
В настоящий момент одиннадцать вакцин находятся на поздней стадии испытаний, в том числе четыре в США и. Успехи Pfizer могут послужить хорошим предзнаменованием для вакцины другой фармацевтической компании — Moderna , в которой используется аналогичная технология. Moderna заявила, что ее результаты испытаний также могут быть получены позже в этом месяце.
Примечательно, что эта новость появилась всего через несколько дней после того, как Джозеф Байден одержал победу над президентом Трампом на президентских выборах в США. Трамп неоднократно намекал, что вакцина будет готова к дню выборов, 3 ноября.
Будет ли вакцина от коронавируса бесплатной?
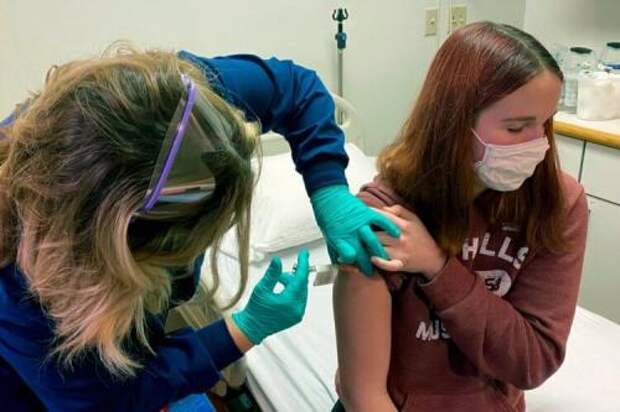
Испытания вакцины Pfizer на добровольцах, фото NY Times
Правительство США обещало выделить Pfizer 1,95 миллиарда долларов на поставку 100 миллионов доз для федерального правительства, которые будут бесплатно переданы американцам. То есть вакцину хотят сделать бесплатной. Однако пока Pfizer не брала никаких денег от американского правительства. И если она справится своими силами, то сможет продавать вакцину.
Данные, опубликованные Pfizer, были представлены в пресс-релизе, а не в рецензируемом медицинском журнале. И это не является окончательным доказательством того, что вакцина безопасна и эффективна, первоначальные данные об эффективности более 90% вакцины могут измениться по мере продолжений испытаний.
Это действительно впечатляющее число, — говорит Акико Ивасаки, иммунолог из Йельского университета. Я не ожидал, что эффективность будет такой высокой. Я готовился примерно к 55%.
Если финальная вакцина будет иметь такой уровень эффективности, он будет выше, чем даже у вакцины против гриппа. Таким образом в мире будет уже две официально зарегистрированные вакцины — американская от Pfizer и российская «Спутник V». Какой вакцине вы бы доверились? Расскажите в комментариях или.
Сколько людей будут участвовать в клинических испытаниях вакцины от коронавируса в США
«Безопасность вакцин должна быть гораздо выше, чем лекарств, ведь лекарства дают больным, а вакцины — здоровым»,— говорят врачи.
Чтобы доказать безопасность вакцины, проводятся клинические испытания. Классический вариант — три фазы, в ходе которых проверяются переносимость , безопасность и, главное, эффективность . Обычно такие исследования длятся не меньше пяти лет. Есть еще доклинические испытания — на клеточной культуре и животной модели; они могут занять около двух лет.
То есть от замысла до воплощения порой проходит 10–15 лет.
Большое значение имеет число участников испытаний. Если в первой фазе это 25–100 человек, то в третьей фазе может быть несколько тысяч. Так, в третьем этапе испытаний оксфордской вакцины от COVID-19, разработанной совместно с AstraZeneca, только в Великобритании собираются участвовать 10 тыс. человек, а еще хотят присоединиться Бразилия и Южная Африка. Но даже такие «масштабные клинические испытания не в состоянии предсказать все возможные редкие эффекты, которые могут проявляться, когда пандемические вакцины будут назначаться многим миллионам людей», написано на сайте ВОЗ в разделе «Безопасность пандемических вакцин (H1N1) — 2009».
Поэтому после начала массовой вакцинации стартует так называемая четвертая фаза — пострегистрационное наблюдение . Только длительное применение препарата или вакцины в условиях реальной жизни помогает оценить отдаленные последствия, то есть, условно говоря, снижается уровень смертности или, наоборот, повышается.
Эта фаза предполагает обратную связь, чтобы разработчик и производитель препарата могли в случае необходимости скорректировать его формулу.
В США врачи и пациенты отправляют информацию в специальное подразделение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, в России — в Росздравнадзор. В случае вакцины от COVID-19 только такой контроль может гарантировать доверие общества, уверены врачи.
Эффективность — вторая важная составляющая любой вакцины. «Наша иммунная система состоит из двух частей — врожденного и адаптивного ответа, который, в свою очередь, подразделяется на гуморальный и клеточный,— объяснил тот же знакомый врач.— Гуморальный ответ на вакцину, как и на любую инфекцию, заключается в формировании специфических антител к каждому конкретному антигену (чужеродному агенту). Клеточный иммунный ответ связан с формированием клеток памяти, которые длительно сохраняются в лимфоидной ткани и несут информацию о том антигене, с которым мы контактировали, в данном случае в ходе вакцинации. Если вдруг мы с этой инфекцией после вакцинации столкнемся, клетки памяти начнут активно работать и нас защищать. Клеточный иммунитет более важен, потому что он более продолжительный». При создании вакцины очень важно подтвердить, что она формирует обе части иммунного ответа.
Как долго продлятся клинические испытания вакцины от коронавируса в США
Российская вакцина от коронавируса стала первой в мире, но по эффективности уступила новому американскому препарату.
Американская биотехнологическая компания Moderna, впервые разработавшая лекарственные средства и вакцины на основе матричной РНК (мРНК), подвела итоги третьей фазы клинических испытаний вакцины против SARS-CoV-2, mRNA-1273, отметив её высокую эффективность.
Назначенный Национальным институтом здравоохранения Совет по мониторингу безопасности данных (DSMB) подтвердил эффективность в 94,5% на основе предварительной оценки результатов третьей фазы клинических испытаний на более чем 30 тысячах добровольцев в США. Препарат вводится в две стадии с промежутком в 14 дней между первой и второй дозой вакцины.
Из числа добровольцев 95 человек заразились коронавирусом, причём 90 случаев инфекции были зафиксированы у тех, кому вводили плацебо, а у 5 заболевших COVID-19, получивших вакцину, коронавирус протекал в лёгкой форме. Все 11 человек, которые оказались из-за инфекции в тяжёлом состоянии, не получали вакцину Moderna.
Как подчеркнули разработчики препарата, никаких серьёзных побочных эффектов у добровольцев не отмечено — зафиксированные нежелательные явления лёгкой и средней тяжести проходили в течение нескольких дней без последствий для организма людей.
Напомним, ранее стало известно, что разработанная американским концерном Pfizer и немецкой компанией BioNTech вакцина-кандидат против SARS-CoV-2 на основе мРНК, BNT162b2, показала 90% эффективность по итогам третьей фазы клинических испытаний, а разработанная российским Национальным исследовательским центром эпидемиологии и микробиологии имени почётного академика Н. Ф. Гамалеи вакцина против SARS-CoV-2 на основе аденовирусных векторов человека, «Спутник V», продемонстрировала 92% эффективность.
Какие результаты ожидаются от клинических испытаний вакцины от коронавируса в США
Все возможные побочные эффекты могут возникать после первого компонента или после второго. Их условно можно разделить на острые и отсроченные реакции.
– Обычно острые реакции связаны с аллергией, то есть с реакцией на какой-то конкретный компонент вакцины, – говорит иммунолог Ксения Бочарова. – Это бывает крайне редко, в среднем, один случай на миллион. Но это может быть острая анафилактическая реакция – состояние, которое без оказания медицинской помощи угрожает здоровью и жизни пациента. Причем счет идет на минуты. Чаще мы имеем дело с отсроченными реакциями. Например, это может быть длительная или слишком выраженная лихорадка, гипотермия (слишком сильное снижение температуры), избыточная болезненность в месте инъекции, увеличение лимфоузлов в районе инъекции. Но здесь подчеркну: эти реакции не относятся к побочным эффектам, это ожидаемые эффекты от вакцины.
Озноб
Это субъективное ощущение холода, которое нередко сочетается с повышенной температурой. При ознобе появляется гусиная кожа и мышечная дрожь, в некоторых случаях – побледнение кожи.
После вакцинации озноб может возникать при температуре и без нее. Справиться с ознобом поможет несколько простых действий:
- закутаться в одеяло и выпить горячий напиток, например чай;
- если озноб сочетается с температурой, то принять жаропонижающие.
Поднялась температура
Гипертермия, то есть повышение температуры тела возникает после введения и других вакцин, например, от гриппа. Температура может подскочить через 5-6 часов после введения вакцины, а в некоторых случаях – на 2-3 день после укола. Насколько поднимется температура, зависит от особенностей организма.
Температура тела выше 38º С говорит о хорошей реакции иммунной системы и нормальном течении поствакцинальной стадии.
После прививки пациентам рекомендовано соблюдать постельный режим, больше отдыхать – это поможет облегчить состояние. Сбивать температуру после вакцинации рекомендовано, только если она превышает 38-38,5º С. Однако пациентам из групп риска, например с сердечно-сосудистыми заболеваниями, сбивать температуру необходимо уже при 38º С.
Ломит тело
Ломота в теле и мышцах может стать следствием повышенной температуры или же иммунного ответа. Справиться с симптомом можно при помощи отдыха, а также снижения температуры тела.
Болит голова
Головная боль может быть следствием повышенной температуры тела, иммунного ответа и индивидуальной реакции на введение препарата. Справиться с болью помогут жаропонижающие препараты, которые обладают и анальгезирующим действием.
Болит место укола
В вакцине существуют буферные растворы, поэтому именно в месте введения формируется первичный иммунный ответ: иммунные клетки «знакомятся» с инфекцией, вырабатывают антитела, которые и обеспечивают защиту.
Боль и покраснение после вакцинации в месте укола – это нормальная реакция организма.
Какие побочные эффекты могут возникнуть после применения вакцины от коронавируса
В ходе клинических исследований (КИ) была достигнута так называемая контрольная точка – 78 подтвержденных случаев заболеваниясреди участников КИ. Это позволило подвести и оценить промежуточные итоги применения вакцины (окончательное завершение 3-й фазы исследований запланировано на 31 декабря 2022 года). Количество добровольцев, включенных в отчет, составило 19 866 человек. Из них 14 964 получили вакцину и 4 902 плацебо. Главные итоги анализа наблюдений за волонтерами оказались такими:
1. Антитела выработались более чем у 98% добровольцев, и у 100% появился клеточный иммунный ответ.
2. Уровень самых важных – вирус-нейтрализующих антител – у вакцинированных оказался в 1,3-1,5 раза выше, чем у пациентов, переболевших ковидом.
3. В целом эффективность вакцины составила 91,6%.
4. У добровольцев старше 60 лет (их было 2 144 человека) подтвердилась эффективность 91,8%, что статистически не отличается от данных у волонтеров 18-60 лет.
5. Вакцина продемонстрировала полную защиту от тяжелых случаев ковида – с такой формой инфекции не слег ни один из участников исследования, получивших прививку препаратом «Спутник V».
6. Подтвердились высокие показатели безопасности: большинство нежелательных явлений (94%) протекали в легкой форме и свелись к простудным синдромам, реакции в месте введения препарата, головной боли и общей слабости.
7. Не зафиксировано ни одного случая сильных аллергических реакций, включая анафилактический шок.
Как будут оценивать эффективность вакцины от коронавируса в клинических испытаниях
Компании Pfizer и BioNTech уже подали заявку на получение разрешения для экстренного использования в Америке разработанной ими вакцины. Ожидается, что первые поставки начнутся до конца декабря

Обновлено в 22:16
Вакцины от коронавируса, разработанные компаниями Moderna и Pfizer, могут начать применяться в США уже в декабре, сообщил в эфире телеканала NBC директор Национального института аллергических и инфекционных заболеваний США Энтони Фаучи.
Корпорация Pfizer в среду заявила о завершении клинических испытаний вакцины от COVID-19, которую она разработала совместно с BioNTech. Эффективность препарата составила 95% среди всех участников и 94% среди пожилых добровольцев. Итоги испытаний были подведены по итогам выявления 170 случаев инфекции. 162 из них пришлись на группу плацебо, и только восемь на вакцинированных. Из десяти пациентов с тяжелым течением болезни только один был из группы вакцины.
Компании в пятницу, 20 ноября, подали заявку на получение разрешения для экстренного использования в США разработанной ими вакцины от коронавируса. По данным CNBC , если американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрит заявку разработчиков, вакцина, вероятно, будет внедряться поэтапно. Первые прививки получат медработники, люди преклонного возраста и с сопутствующими заболеваниями. Следующими смогут привить учителей, работников приютов и тюрем.
Разработанная Центром Гамалеи и 48-м ЦНИИ Минобороны российская вакцина «Спутник V» была зарегистрирована до завершения третьей фазы испытаний. Ее критиковали на Западе, в том числе за то, что на тот момент не было доказательств эффективности препарата. Но и американский регулятор, скорее всего, зарегистрирует вакцину, созданную Pfizer и BioNTech, не дожидаясь официальной публикации всех результатов третьей фазы исследований. Правда, подход к испытаниям у нас и у них различался, говорит профессор Сколковского института науки и технологий («Сколтех») Дмитрий Кулиш .
— Есть в современной фармацевтике две школы мысли. Одна школа считает, что если мы досконально на многих тысячах пациентов много лет препарат не проверяли, мы не имеем морально-этического права предлагать этот препарат пациентам. А другая школа говорит, что пациент не идиот, он сам разберется без вашего участия, поэтому вы, пожалуйста, проведите очень короткие испытания на коленке и давайте пациенту, пациент дальше сам решит. Соответственно, только что наше российское руководство приняло решение пойти по второму пути, и это хорошо, я это очень поддерживаю, всегда поддерживаю. Американское руководство сейчас будет регистрировать вакцину Pfizer на данных гораздо больших, чем были у «Спутника V», когда он был зарегистрирован. Я честно признаю, что я пока не поднимал документы, связанные с регистрацией вакцины Pfizer, но я думаю, что там показания гораздо шире, чем у нас. Потому что, например, клинические испытания «Спутника» не включают не только ослабленной группы населения, но также, например, группы населения со следами коронавирусной инфекции и некоторых других инфекций. А исследования Pfizer, наоборот, включают практически все, что движется. Поэтому я думаю, что и зарегистрируются они по гораздо более широкому набору показаний.
— И все-таки сроки. США рассчитывает получить 25 млн доз в декабре. Смогут Pfizer и BioNTech справиться с этим?
— Конечно, 20 млн доз — это много, и я не знаю, что там происходит, было бы самонадеянно говорить, что я знаю. Но я знаю несколько вещей, которые предсказывают, что все будет у них хорошо и все они сделают. Во-первых, Pfizer — это огромная, мощнейшая, умная компания, и поскольку они наверняка заранее все просчитали, наверняка они уже два-три месяца готовятся к этому производству. Во-вторых, ирония этих мРНКовых вакцин в том, что они в производстве гораздо проще и дешевле, чем аденовирусная. И это приведет сейчас к большим скандалам, связанным с их прайсингом и с их размещением производства в мире. То есть, например, скоро индийцы на коленке сделают то же самое и начнут этим торговать по три копейки. Мы посмотрим, чем это все закончится. Это сводится к тому, что, поскольку компания огромная, готовилась долго, а производство очень простое, я думаю, произведут они эти 25 млн доз.
Какие группы населения будут принимать участие в клинических испытаниях вакцины от коронавируса в США
РИА Новости . Глава Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США Стивен Хан заявил в интервью изданию Financial Times, что готов одобрить вакцину от коронавируса до завершения третьей фазы клинических испытаний, если выгода будет превышать возможные риски.
В США проходят клинические испытания вакцин против коронавируса, разработанных такими компаниями, как Moderna, Pfizer и AstraZeneca. Ранее президент США Дональд Трамп говорил, что вакцина от COVID-19 может быть готова в США ко дню президентских выборов 3 ноября.
Отмечается, что Хан готов обойти установленный процесс одобрения вакцины, однако не для того, чтобы угодить Трампу.
“Зависит от спонсора (разработчика вакцины) подавать ли заявку на авторизацию или одобрение, а мы выносим экспертное заключение по их заявке. Если они сделают это до завершения третьей фазы, мы можем посчитать это оправданным. Мы можем посчитать это неоправданным, мы примем решение”, – заявил Хан.
Хан отметил, что существует безопасный способ сделать вакцину доступной для населения до окончания испытаний, например, путем выдачи экстренного разрешения на её применение лишь определенными группами.
“Наше экстренное разрешение не равноценно широкому одобрению. Законодательный, медицинский и научный стандарт для этого – выгода перевешивает риски в условиях чрезвычайной ситуации в области общественного здравоохранения”, – заявил он.
“Это не будет политическим решением”, – добавил Хан.
Ранее глава аппарата Белого дома Марк Медоуз заявил, что США не примут результаты испытаний российской вакцины против коронавируса. Он отметил, что у США есть протоколы FDA и “высочайшие в мире стандарты в области здравоохранения и безопасности”, которых они будут придерживаться. В августе Трамп заявил, что надеется, что российская вакцина сработает, но отметил, что Россия “убрала некоторые исследования”, а США считают важным пройти через весь “процесс”.
Минздрав России ранее зарегистрировал первую в мире вакцину для профилактики COVID-19, разработанную НИЦЭМ имени Гамалеи и производимую совместно с Российским фондом прямых инвестиций. Глава РФПИ Кирилл Дмитриев сообщал, что фонд получил заявки более чем из 20 стран на приобретение миллиарда доз отечественной вакцины от коронавируса. При этом он отмечал, что Россия договорилась о производстве вакцины в пяти странах, имеющиеся мощности позволяют произвести 500 миллионов доз за год.
Как будут защищены участники клинических испытаний вакцины от коронавируса в США
Президент США Дональд Трамп заявил, что вакцина от коронавируса, создаваемая в данный момент одной из частных госкорпораций, появится не раньше октября. Рассказывая о сроках создания вакцины, Трамп отметил, что этим вопросом занимается сразу несколько компаний. Johnson & Johnson, Merck, Moderna и Pfizer максимально близки к созданию вакцины, однако неизвестно, какой в конечном счёте окажется американская вакцина от CoViD-19 — данных о её эффективности не было даже на предварительном этапе создания.
Особенность применения американской вакцины такова, что ни один производитель пока не может претендовать на звание монополиста в области производства сыворотки: у одних есть решение, но нет производства в достаточных количествах, у других есть производство, но хромает научно-исследовательская база. Есть и другая проблема: пока в США наблюдается взрывной рост заболевших коронавирусом (в среднем, по 28–30 тысяч человек в сутки), а вакцины нет, фармкомпании продолжают извлекать сверхприбыли из продажи противовирусных препаратов.
Бывший сотрудник французского центра исследований в области разведки Анри Беккер отметил, что такой подход может угрожать национальной безопасности США, однако переломить ситуацию в данный момент президент страны пока не может.
Наблюдается явное отсутствие быстрого прогресса. В лечении они смогли добиться существенных результатов, но создание вакцины в США пока слабо контролируется государственными структурами
Анри Беккер
Бывший сотрудник французского центра исследований в области разведки
Отсюда же, по словам Беккера, заявления представителей разведслужб США о попытках неизвестных завладеть результатами американских лабораторий.
Как будут использованы результаты клинических испытаний вакцины от коронавируса в США для дальнейшего развития вакцины
В США первой компанией, начавшей клинические испытания, стала Moderna. Она16 марта при исследовательском центре Kaiser Permanente Washington Health Research Institute. В рамках исследования две дозы препарата с интервалом в месяц введут 45 добровольцам в возрасте от 18 до 55 лет. Прототип получил название mRNA-1273. Особенность подхода Moderna заключается в том, что в вакцине нет возбудителя — только кусочек его генетического кода. Разработкой вакцины в США занимаются также Arcturus Therapeutics, Johnson & Johnson и Inovio Pharmaceuticals in the US.
Основные игроки в Европе — две немецкие биофармацевтические компании, BioNTech и CureVac. Они специализируются на исследованиях матричной РНК-терапии (мРНК-терапии), также известной как «антисмысловая». Этот метод лечения основан на выключении синтеза белка, участвующего в развитии заболевания. CureVac собирается начать клинические тесты своей вакцины от коронавируса летом; компания разрабатывает ее совместно с федеральным Институтом Пауля Эрлиха по производству вакцин и биомедицинских лекарственных средств. В понедельник, 16 марта, CureVac сообщила о намерениисвои производственные мощности, чтобы в будущем иметь возможность производить «миллиарды вакцин».
BioNTech планирует начать клинические испытания уже в апреле этого года. Компании помогают в разработкеи.
В Китае в ближайшее время такжеклинические испытания. Прототип вакцины, названный Ad5-nCoV, разработала Академия военно-медицинских наук Китая совместно с гонконгской компанией CanSino Biologics. 16 марта они получили разрешение от властей КНР на проведение тестов на людях. Исследователи собираются ввести вакцину 108 здоровым гражданам от 18 до 60 лет в трех разных дозировках, свидетельствуетклинических испытаний. Тесты будут проводиться в лаборатории в Ухане.
В Великобритании первые клинические испытания вакцины под названием ChAdOx1в следующем месяце — прототип разрабатывает группа ученых из Оксфордского университета. В марте должны начаться доклинические тесты на животных, они пройдут в лаборатории Портон-Даун под Солсбери.
18 марта о начале испытанийи Всемирная организация здравоохранения.
Между Китаем и США разворачивается гонка за первенство в создании вакцины. Для КНР первой создать вакцину стало вопросом национального престижа: Пекин рассматривает сложившуюся ситуацию как отличную возможность распространить свое влияние в мире за счет оказания помощи странам, страдающим от эпидемии, пишет The New York Times. Китай предоставляет своих специалистов и оказывает гуманитарную помощь Европе: в частности, 18 марта он объявил о планах отправить туда более 2 млн медицинских масок и 50 тыс. тестов на коронавирус.
В свою очередь, США, как стало известно из публикации немецкого издания Welt am Sonntag, пытались за $1 млрд перекупить вирусологов CureVac и перевезти на свою территорию штаб-квартиру компании из немецкого Тюбингена. Предложение о продаже главе CureVac Даниэлю Маникелле было сделано на встрече американского президента Дональда Трампа с топ-менеджерами фармацевтических компаний 2 марта в Белом доме. 11 марта Маникелла неожиданно и без объяснения причин покинул CureVac, а вместо него председателем правления компании стал создатель компании Ингмар Хёрр, который отошел от управления в 2018 году.
Планы администрации США вызвали негативную реакцию руководства ФРГ. Министр экономики страны Петер Альтмайер и глава МВД Хорст Зеехофер подтвердили, что американцы пытались купить CureVac. Больше всего немцев возмутил тот факт, что исследователям предлагалось сделать свои наработки доступными только для американцев. Власти Германии не позволят, чтобы другие страны присваивали себе исключительные права на наработки немецких вирусологов по вакцине от коронавируса, заявил глава МИД ФРГ Хайко Маас.
<!—->
Свежие комментарии